Atom
memiliki kecenderungan untuk mencapai kestabilan dengan cara berikatan dengan
atom lain. Elektron yang berperan pada pembentukan ikatan kimia adalah elektron
valensi dari suatu atom/unsur yang terlibat. Salah satu petunjuk dalam
pembentukan ikatan kimia adalah adanya golongan unsur yang stabil yaitu
golongan VIIIA atau golongan 18 (gas mulia). Oleh sebab itu dalam
pembentukan ikatan kimia, atom-atom akan membentuk konfigurasi elektron seperti
pada unsur gas mulia.
Unsur
gas mulia mempunyai elektron valensi sebanyak 8 (oktet) kecuali Helium 2
(duplet), seperti terlihat pada table di bawah ini.
|
Periode
|
Unsur
|
Nomor Atom
|
K
|
L
|
M
|
N
|
O
|
P
|
|
1
|
He
|
2
|
2
|
|||||
|
2
|
Ne
|
10
|
2
|
8
|
||||
|
3
|
Ar
|
18
|
2
|
8
|
8
|
|||
|
4
|
Kr
|
36
|
2
|
8
|
18
|
8
|
||
|
5
|
Xe
|
54
|
2
|
8
|
18
|
18
|
8
|
|
|
6
|
Rn
|
86
|
2
|
8
|
18
|
32
|
18
|
8
|
Kecenderungan
unsur-unsur untuk menjadikan konfigurasi elektronnya sama seperti gas mulia
terdekat dikenal dengan istilah Aturan Oktet. Untuk mengilustrasikan ikatan
kimia dapat dilakukan dengan menuliskan rumus Lewis dan rumus ikatan.
·
Ikatan
kimia dibedakan menjadi 4 yaitu :
Atom
memiliki kecenderungan untuk mencapai kestabilan dengan cara berikatan dengan
atom lain. Elektron yang berperan pada pembentukan ikatan kimia adalah elektron
valensi dari suatu atom/unsur yang terlibat. Salah satu petunjuk dalam
pembentukan ikatan kimia adalah adanya golongan unsur yang stabil yaitu
golongan VIIIA atau golongan 18 (gas mulia). Oleh sebab itu dalam
pembentukan ikatan kimia, atom-atom akan membentuk konfigurasi elektron seperti
pada unsur gas mulia.
Unsur
gas mulia mempunyai elektron valensi sebanyak 8 (oktet) kecuali Helium 2
(duplet), seperti terlihat pada table di bawah ini.
|
Periode
|
Unsur
|
Nomor Atom
|
K
|
L
|
M
|
N
|
O
|
P
|
|
1
|
He
|
2
|
2
|
|||||
|
2
|
Ne
|
10
|
2
|
8
|
||||
|
3
|
Ar
|
18
|
2
|
8
|
8
|
|||
|
4
|
Kr
|
36
|
2
|
8
|
18
|
8
|
||
|
5
|
Xe
|
54
|
2
|
8
|
18
|
18
|
8
|
|
|
6
|
Rn
|
86
|
2
|
8
|
18
|
32
|
18
|
8
|
Kecenderungan
unsur-unsur untuk menjadikan konfigurasi elektronnya sama seperti gas mulia
terdekat dikenal dengan istilah Aturan Oktet. Untuk mengilustrasikan ikatan
kimia dapat dilakukan dengan menuliskan rumus Lewis dan rumus ikatan.
·
Ikatan
kimia dibedakan menjadi 4 yaitu :
-
Ikatan
ion
-
Ikatan
kovalen
-
Ikatan
kovalen koordinasi
-
Ikatan
logam
Ø
Ikatan
kovalen terdiri dari :
-
Ikatan
kovalen tunggal
-
Ikatan
kovalen rangkap dua
-
Ikatan
kovalen rangkap tiga
-
Ikatan
kovalen polar
-
Ikatan
kovalen non polar
v
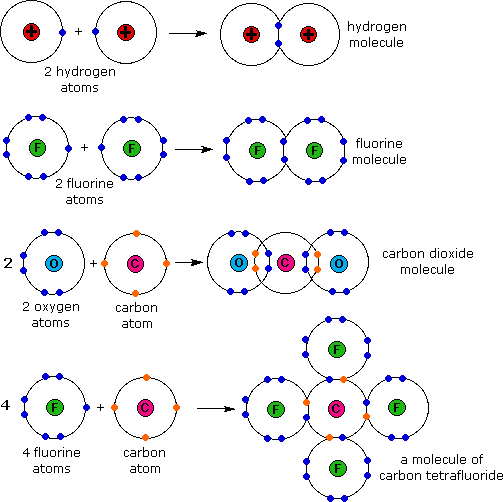
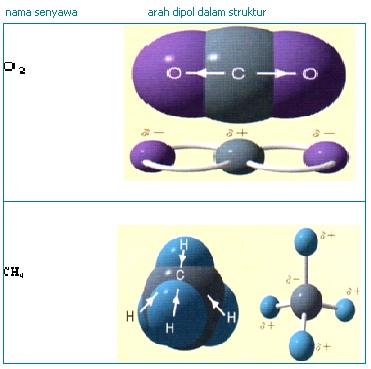
Contoh
Ikatan Kovalen, lihat gambar di bawah ini !
IKATAN ION ATAU KEELEKTROVALEN
Ikatan ion adalah ikatan yang terjadi
akibat perpindahan elektron dari satu atom ke atom lain (James E. Brady, 1990).
Ikatan ion terbentuk antara atom yang melepaskan elektron (logam) dengan atom
yang menangkap elektron (bukan logam). Atom logam, setelah melepaskan elektron
berubah menjadi ion positif. Sedangkan atom bukan logam, setelah menerima
elektron berubah menjadi ion negatif. Antara ion-ion yang berlawanan muatan ini
terjadi tarik-menarik (gaya elektrostastis) yang disebut ikatan ion (ikatan
elektrovalen).
Ikatan ion merupakan ikatan yang relatif
kuat. Pada suhu kamar, semua senyawa ion berupa zat padat kristal dengan
struktur tertentu. Dengan mengunakan lambang Lewis, pembentukan NaCl
digambarkan sebagai berikut.
NaCl
mempunyai struktur yang berbentuk kubus, di mana tiap ion Na+dikelilingi oleh 6 ion Cl– dan tiap ion Cl– dikelilingi
oleh 6 ion Na+.
Senyawa
ion dapat diketahui dari beberapa sifatnya, antara lain:
1.
Merupakan zat padat dengan titik leleh
dan titik didih yang relatif tinggi. Sebagai contoh, NaCl meleleh pada 801 °C.
2.
Rapuh, sehingga hancur jika dipukul.
3.
Lelehannya menghantarkan listrik.
4.
Larutannya dalam air dapat menghantarkan
listrik.
Contoh lain pembentukan ikatan ion
sebagai berikut.
a. Pembentukan MgCl2
Mg (Z = 12) dan Cl (Z = 17) mempunyai konfigurasi elektron sebagai berikut.
- Mg : 2, 8, 2
- Cl : 2, 8, 7
Mg dapat mencapai konfigurasi gas mulia dengan melepas 2 elektron,
sedangkan Cl dengan menangkap 1 elektron. Atom Mg berubah menjadi ion
Mg2+, sedangkan atom Cl menjadi ion Cl–.
- Mg (2, 8, 2) ⎯⎯→ Mg2+ (2, + 2 e–
+ 2 e–
(konfigurasi elektron ion Mg2+ sama dengan neon)
- Cl (2, 8, 7) + e– ⎯⎯→ Cl– (2, 8, (konfigurasi
elektron ion Cl– sama dengan argon)
(konfigurasi
elektron ion Cl– sama dengan argon)
Ion Mg2+ dan ion Cl– kemudian bergabung membentuk senyawa dengan rumus MgCl2.
Dengan menggunakan lambang Lewis, pembentukan MgCl2 dapat digambarkan sebagai berikut.
a. Pembentukan MgCl2
Mg (Z = 12) dan Cl (Z = 17) mempunyai konfigurasi elektron sebagai berikut.
- Mg : 2, 8, 2
- Cl : 2, 8, 7
Mg dapat mencapai konfigurasi gas mulia dengan melepas 2 elektron,
sedangkan Cl dengan menangkap 1 elektron. Atom Mg berubah menjadi ion
Mg2+, sedangkan atom Cl menjadi ion Cl–.
- Mg (2, 8, 2) ⎯⎯→ Mg2+ (2,
(konfigurasi elektron ion Mg2+ sama dengan neon)
- Cl (2, 8, 7) + e– ⎯⎯→ Cl– (2, 8,
Ion Mg2+ dan ion Cl– kemudian bergabung membentuk senyawa dengan rumus MgCl2.
Dengan menggunakan lambang Lewis, pembentukan MgCl2 dapat digambarkan sebagai berikut.
b.
Ikatan antara atom 12Mg dan  dalam MgO
dalam MgO
Konfigurasi elektron Mg dan O adalah:
Mg : 2, 8, 2 (melepas 2 elektron)
O : 2, 6 (menangkap 2 elektron)
Atom O akan memasangkan 2 elektron, sedangkan atom Mg juga akan
memasangkan 2 elektron.
Konfigurasi elektron Mg dan O adalah:
Mg : 2, 8, 2 (melepas 2 elektron)
O : 2, 6 (menangkap 2 elektron)
Atom O akan memasangkan 2 elektron, sedangkan atom Mg juga akan
memasangkan 2 elektron.
c . Ikatan ion pada 19K dan  dalam K2O
dalam K2O
Konfigurasi elektron:
K : 2, 8, 8, 1 (melepas 1 elektron) membentuk K+
O : 2, 6 (menerima 2 elektron) membentuk O2–
2 K+ + O2– ⎯⎯→ K2O
Konfigurasi elektron:
K : 2, 8, 8, 1 (melepas 1 elektron) membentuk K+
O : 2, 6 (menerima 2 elektron) membentuk O2–
2 K+ + O2– ⎯⎯→ K2O
d. Ikatan ion pada Fe (elektron valensi
3) dengan Cl (elektron valensi 7)
membentuk FeCl3
Fe mempunyai elektron valensi 3 akan membentuk Fe3+
Cl mempunyai elektron valensi 7 akan membentuk Cl–
Fe3+ + 3 Cl– ⎯⎯→ FeCl3
membentuk FeCl3
Fe mempunyai elektron valensi 3 akan membentuk Fe3+
Cl mempunyai elektron valensi 7 akan membentuk Cl–
Fe3+ + 3 Cl– ⎯⎯→ FeCl3
Ikatan
Ion dan Ikatan Kovalen serta Sifat-sifat Senyawanya – Ada 2 jenis ikatan
kimia yang akan kita pelajari dalam bab ini yaitu ikatan ion dan ikatan
kovalen.
A. Ikatan Ion
A. Ikatan Ion
Ikatan
ion terbentuk karena adanya gaya tarik-menarik elektrostatis antara ion positif
dengan ion negatif. ikatan ion pada umumnya terjadi antara atom-atom yang
mempunyai energi ionisasi terendah dengan atom-atom yang mempunyai afinitas
elektron besar. Ikatan ini terjadi antara atom yang cenderung melepaskan
elektron ( atom logam ) dengan atom yang cenderung menerima elektron ( atom
nonlogam ). Senyawa yang terbentuk melalui ikatan ion disebut senyawa ionik.
Contoh : NaCl
Contoh : NaCl
Sifat umum senyawa yang berikatan ion:
1. Titik lebur dan titik didih yang tinggi
2. Dalam keadaan lebur dan larutan dapat menghantarkan arus listrik atau bersifat konduktor.
3. Keras dan mudah patah
4. Mudah larut dalam air
5. Tidak larut dalam pelarut nonpolar
IKATAN KOVALEN
Ikatan
kovalen merupakan ikatan yang terbentuk karena pemakaian pasangan elektron
bersama. Untuk menggambarkan bagaimana ikatan kovalen terjadi digunakan rumus
titik elektron (struktur lewis).
• Ikatan kovalen Tunggal (ikatan kovalen yang melibatkan sepasang elektron untuk dipakai bersama).
Contoh : ikatan yang terjadi pada molekul H2
• Ikatan kovalen Tunggal (ikatan kovalen yang melibatkan sepasang elektron untuk dipakai bersama).
Contoh : ikatan yang terjadi pada molekul H2
• Ikatan kovalen
rangkap dua (ikatan kovalen yang melibatkan dua pasang elektron untuk dipakai
bersama).
Contoh : ikatan yang terjadi pada molekul oksigen
O=O
• Ikatan kovalen rangkap 3 (ikatan kovalen yang melibatkan tiga pasang elektron untuk dipakai bersama).
Contoh : ikatan yang terjadi pada molekul Nitrogen
Contoh : ikatan yang terjadi pada molekul oksigen
O=O
• Ikatan kovalen rangkap 3 (ikatan kovalen yang melibatkan tiga pasang elektron untuk dipakai bersama).
Contoh : ikatan yang terjadi pada molekul Nitrogen
Sifat umum senyawa kovalen :
1. Titik lebur dan titik didih yang rendah
2. Tidak dapat menghantarkan arus listrik , akan tetapi senyaw akovalen polar dalam bentuk larutan dapat menghantarkan listrik.
3. Pada umumnya lunak
4. Tidak larut dalam air
5. Larut dalam pelarut nonpolar
Ikatan
Kovalen adalah ikatan antar atom berdasar penggunaan elektron secara bersama- sama.
Umumnya terjadi antara atom-atom non logam dengan atom non logam.
Ikatan kovalen
terbentuk diantara dua atom yang sama-sama ingin menangkap elektron.
Gabungan atom-atom
melalui ikatan kovalen dinamakan Molekul. Molekul ini berupa molekul unsur
(contohnya Cl2, O2, P4) dan Molekul senyawa (contohnya HCl, CO2, CH4).
Ikatan kovalen
dibedakan menjadi:
I.
Ikatan
kovalen tunggal,adalah ikatan dengan satu pasang elektron milik bersama.Di
gambarkan dengan tanda satu garis ikatan.Contoh : ikatan antara atom H (non logam)
dan atom Cl (non logam).
II.
Ikatan
kovalen rangkap dua,adalah ikatan dengan dua pasang elektron milik bersama.Di
gambarkan dengan tanda dua garis ikatan.Contoh : ikatan antar atom O (non
logamIkatan ini melibatkan dua pasang elektron yang diguanakan secara
bersama-sama. Contoh senyawa
ikatan kovalen rangkap dua adalah O2 dan CO2.
III.
Ikatan
kovalen rangkap tiga,adalah ikatan dengan tiga pasang elektron milik bersama.Di
gambarkan dengan tanda tiga garis ikatan.Contoh : ikatan antar atom N.
-
Ikatan
kovalen kordinasi,adalah ikatan kovalen dimana elektron-elektron dalam pasangan
elektron yang digunakan bersama berasal dari salah satu atom yang berikatan.
Ikatan kovalen ini hanya dapat terbentuk apabila salah satu atum mempunyai
pasangan elektron bebas (PEB).
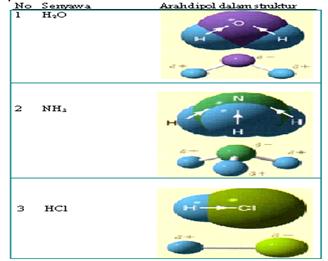
Kepolaran
ikatan kovalen
1. Ikatan Kovalen
Polar
Ikatan kovalen
polar tejadi jika pasangan elektron yang dipakai bersama, tertarik lebih kuat
ke salah satu atom berikatan.
Kepolaran senyawa
akan bertambah jika beda keelektronegatifan atom-atom yang berikatan semakin
besar.
Contoh :
2. Ikatan Kovalen
Non Polar
Ikatan kovalen
nonpolar tejadi jika pasangan elektron yang dipakai bersama, tertarik ke semua
atom berikatan
Contoh :
Kepolaran suatu
senyawa kovalen dapat ditentukan berdasarkan :
a. Perbedaan
keelektronegatifan atom-atom yang membentuk senyawa
b. Bentuk molekul
senyawa kovalen
POLARISASI IKATAN KOVALEN
1. IKATAN KOVALEN POLAR DAN KOVALEN NONPOLAR
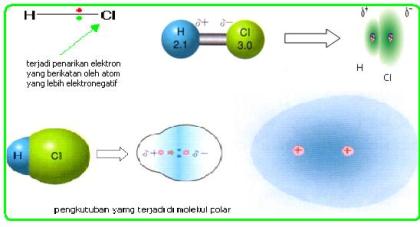
Ikatan
kovalen polar adalah suatu ikatan kovalen dimana elektron-elektron yang
membentuk ikatan lebih banyak menghabiskan waktunya untuk berputar dan
berkeliling disekitar salah satu atom. Pada molekul HCl elektron yang berikatan
akan lebih dekat kepada atom klor daripada Hidrogen. Polaritas ikatan ini dapat
digambarkan dalam bentuk panah atau symbol δ+ , δ-. δ+ adalah tanda bahwa atom
lebih bersifat elektropositif di banding dengan atom yang menjadi pasangannya.
δ- berarti bahaw atom lebih bersifat elektronegatif daripada atom yang menjadi
pasangan ikatannya.
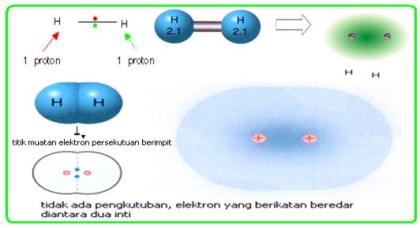
Ikatan1
Ikatan kovalen nonpolar
Kovalen
murni (non polar) adalah memiliki ciri Titik muatan negatif elektron
persekutuan berhimpit, sehingga pada molekul pembentukuya tidak terjadi momen
dipol, dengan perkataan lain bahwa elektron persekutuan mendapat gaya tarik
yang sama.
Struktur H2 dan CO2 adalah contoh ikatan kimia non polar karena daya tariknya seimbang baik antara H dengan H atau antar O dengan C kiri dan kanan seimbang. Sehingga momen dipolnya menjadi nol. Contoh lain adalah senyawa CH4, H2, O2, Br2 dan lain-lain.
PERBANDINGAN SIFAT SENYAWA ION DAN SENYAWA KOVALEN
Jika
di dapur terdapat cuka (senyawa kovalen) dan garam dapur (senyawa ion), senyawa
mana yang akan tercium baunya? Tentu yang tercium adalah cuka. Mengapa garam
dapur tidak tercium baunya? Jika Anda merasakan bau sesuatu, berarti ada gas
atau uap dari suatu zat yang masuk ke hidung Anda. Uap tersebut tentu berasal
dari zat yang ada di sekitar Anda. Jika suatu zat berwujud padat atau cair
tercium baunya, berarti zat tersebut mudah menguap atau memiliki titik didih
relatif rendah pada tekanan normal. Pada kasus tersebut, cuka mudah menguap
dibandingkan garam dapur. Titik didih cuka 119°C dan garam dapur 1.517°C.
Kemudahan menguap dari suatu zat berhubungan dengan gaya tarik antarmolekul.
Gaya
tarik antarmolekul harus dibedakan dengan ikatan antaratom dalam molekul. Gaya
tarik antarmolekul adalah antaraksi antarmolekul yang berdampak pada wujud zat
bersangkutan, sedangkan ikatan antaratom adalah antaraksi antara atom-atom yang
membentuk molekul atau senyawa.
Gaya
tarik antarmolekul dalam senyawa kovalen relatif lemah dibandingkan senyawa
ion. Akibatnya, senyawa kovalen pada umumnya mudah menguap dibandingkan senyawa
ion, kecuali senyawa kovalen yang membentuk jaringan raksasa, seperti intan dan
grafit. Kemudahan menguap dari senyawa kovalen banyak dimanfaatkan sebagai
parfum ataudeodorant. Sejumlah kecil senyawa kovalen yang dicampurkan ke dalam
produk komersial memberikan bau yang harum. Gambar 3.14 dan Gambar
3.15menunjukkan contoh-contoh produk komersial yang mengandung senyawa kovalen.
Gambar 3.14 Produk-produk
komersial yang mengandung senyawa kovalen.
Gambar 3.15 Senyawa
kovalen banyak diaplikasikan dalam produk kosmetik.
Logam
dapat menghantarkan arus listrik disebabkan oleh elektronelektronnya bergerak
bebas di seluruh kisi logam. Apakah senyawa ion dan senyawa kovalen dapat
menghantarkan arus listrik? Untuk dapat menjawab pertanyaan tersebut, Anda
dapat mempelajari kegiatan penyelidikan berikut.
Serbuk NaCl
dimasukkan ke dalam cawan pijar dan dihubungkan dengan alat uji hantaran
listrik. Berdasarkan penyelidikan, diperoleh data sebagai berikut.
1. Dalam wujud
padat, senyawa ion tidak dapat menghantarkan listrik, tetapi dalam wujud cair
(meleleh) dapat menghantarkan arus listrik.
2. Senyawa
kovalen, baik dalam keadaan padat maupun cairan tidak dapat menghantarkan arus
listrik. Mengapa terjadi gejala seperti itu?
Dalam
bentuk padatan, senyawa ion membentuk kisi-kisi kristal yang kaku. Dalam hal
ini, kation dan anion berantaraksi sangat kuat satu dan lainnya sehingga tidak
dapat bergerak bebas. Oleh karena kation dan anion tidak dapat bergerak
melainkan hanya bergetar di tempat, akibatnya tidak ada spesi yang dapat
menghantarkan arus listrik. Ketika senyawa ion dilelehkan, antaraksi antara
kation dan anion melemah dan dapat bergerak lebih leluasa. Akibatnya, jika arus
listrik dilewatkan, ion-ion tersebut dapat menghantarkan arus listrik dari
potensial tinggi ke potensial rendah. Pada senyawa kovalen, baik bentuk padatan
maupun cairannya bersifat netral. Artinya, tidak terjadi pemisahan atom-atom membentuk
ion yang bermuatan listrik, melainkan tetap sebagai molekul kovalen. Oleh
karena dalam senyawa kovalen tidak ada spesi yang bermuatan listrik maka arus
listrik yang dikenakan pada senyawa kovalen tidak dapat dialirkan.
Bagaimana kelarutan
senyawa kovalen dan senyawa ion di dalam pelarut tertentu? Untuk mengetahui
kelarutan senyawa-senyawa itu, Anda dapat mempelajari penyelidikan berikut.
Setiap tiga macam zat terlarut, NaCl, naftalena, dan gula dimasukkan pada tiga
macam pelarut, misalnya air, alkohol, dan benzena sehingga diperoleh 9 macam
larutan.
Berdasarkan hasil
penyelidikan diketahui bahwa:
1. senyawa NaCl
(senyawa ion) larut dalam pelarut air, tetapi tidak larut dalam pelarut organik
seperti alkohol dan benzena;
2. naftalena larut
dalam benzena, tetapi tidak larut dalam air maupun alkohol;
3. gula pasir
larut dalam air dan alkohol, tetapi tidak larut dalam pelarut benzena.
Apa yang dapat
Anda simpulkan tentang data tersebut? Bagaimana menjelaskan fakta tersebut? Pada
umumnya, senyawa ion tidak larut dalam pelarut organik, tetapi larut dalam air
walaupun ada juga yang kurang bahkan tidak larut dalam air.
Mengapa gula pasir
(C12H22O11) larut dalam air dan alkohol, tetapi tidak larut dalam benzena,
sedangkan naftalena larut dalam benzena, tetapi tidak larut dalam air maupun
alkohol? Gula pasir dan naftalena, keduanya senyawa kovalen. Bedanya, gula
pasir merupakan senyawa kovalen polar, sedangkan naftalena kovalen murni
(nonpolar). Selain itu, air dan alkohol juga polar, sedangkan benzena nonpolar.
Berdasarkan
uraian tersebut, dapat disimpulkan bahwa pada umumnya senyawa kovalen
polar akan larut dalam pelarut polar, sedangkan senyawa kovalen nonpolar akan
larut dalam pelarut yang juga nonpolar. Alkohol yang bersifat kovalen polar
akan larut dalam air yang juga bersifat polar dan alkohol tidak akan larut
dalam pelarut benzena. Perbedaan utama antara senyawa ion dan senyawa kovalen
dapat dilihat pada Tabel 3.5.
|
No
|
Sifat-sifat
fisika
|
Senyawa ion
|
Senyawa kovalen
|
|
1
|
Titik didih dan
titik
Leleh
|
Tinggi
|
Rendah
|
|
2
|
Konduktivitas
listrik
|
Sebagai
konduktor
dalam bentuk
lelehan
atau larutan
dalam air
|
Bukan konduktor
dalam
setiap keadaan
|
|
3
|
Kelarutan dalam
air
|
Umumnya larut
|
Senyawa kovalen
polar
|
|
4
|
Kelarutan dalam
pelarut polar
|
Tidak larut
|
Umumnya larut
dalam
air dan pelarut
polar
|
|
5
|
Kelarutan dalam
pelarut nonpolar
|
Tidak larut
|
Senyawa kovalen
nonpolar umumnya
larut
|
PENGECUALIAN DAN KEGAGALAN ATURAN OKTET
A. Pengecualian Aturan Oktet
Pengecualian aturan oktet dapat dibagi dalam tiga kelompok
sebagai berikut.
1. Senyawa yang tidak mencapai aturan oktet.
Senyawa yang atom pusatnya mempunyai elektron valensi kurang dari 4 termasuk dalam kelompok ini. Hal ini menyebabkan setelah semua elektron valensinya dipasangkan tetap belum mencapai oktet. Contohnya adalah BeCl2, BCl3, dan AlBr3
1. Senyawa yang tidak mencapai aturan oktet.
Senyawa yang atom pusatnya mempunyai elektron valensi kurang dari 4 termasuk dalam kelompok ini. Hal ini menyebabkan setelah semua elektron valensinya dipasangkan tetap belum mencapai oktet. Contohnya adalah BeCl2, BCl3, dan AlBr3
2. Senyawa dengan jumlah elektron valensi ganjil. Contohnya
adalah NO2, yang mempunyai elektron valensi (5 + 6 + 6) = 17.
Kemungkinan rumus Lewis untuk NO2 sebagai berikut.
3. Senyawa yang melampaui aturan oktet.
Ini terjadi pada unsur-unsur periode 3 atau lebih yang dapat menampung lebih dari 8 elektron pada kulit terluarnya (ingat, kulit M dapat menampunghingga 18 elektron). Beberapa contoh adalah PCl5, SF6, ClF3, IF7, dan SbCl5. Perhatikan rumus Lewis dari PCl
5, SF6, dan ClF3 berikut ini.
Ini terjadi pada unsur-unsur periode 3 atau lebih yang dapat menampung lebih dari 8 elektron pada kulit terluarnya (ingat, kulit M dapat menampunghingga 18 elektron). Beberapa contoh adalah PCl5, SF6, ClF3, IF7, dan SbCl5. Perhatikan rumus Lewis dari PCl
5, SF6, dan ClF3 berikut ini.
B. Kegagalan Aturan Oktet
Aturan oktet
gagal meramalkan rumus kimia senyawa dari unsur transisi maupun postransisi.
Unsur postransisi adalah unsur logam setelah unsur transisi, misalnya Ga, Sn,
dan Bi. Sn mempunyai 4 elektron valensi, tetapi senyawanya lebih banyak dengan
tingkat oksidasi +2. Begitu juga Bi yang mempunyai 5 elektron valensi, tetapi
senyawanya lebih banyak dengan tingkat oksidasi +1 dan +3. Pada umumnya, unsur
transisi maupun unsur postransisi tidak memenuhi aturan oktet.
Ikatan Logam
Ikatan elektron-elektron valensi dalam atom logam bukanlah
ikatan ion, juga bukan ikatan kovalen sederhana. Suatu logam terdiri dari suatu
kisi ketat dari ion- ion positif dan di sekitarnya terdapat lautan (atmosfer)
elektron-elektron valensi. Elektron valensi ini terbatas pada
permukaan-permukaan energi tertentu, namun mempunyai cukup kebebasan, sehingga
elektron-elektron ini tidak terus-menerus
digunakan bersama oleh dua ion yang sama. Bila diberikan energi, elektron-elektron ini mudah dioperkan dari atom ke atom. Sistem ikatan ini unik bagi logam dan dikenal sebagai ikatan logam.
digunakan bersama oleh dua ion yang sama. Bila diberikan energi, elektron-elektron ini mudah dioperkan dari atom ke atom. Sistem ikatan ini unik bagi logam dan dikenal sebagai ikatan logam.
STRUKTUR LEWIS
Struktur
Lewis adalah diagram yang menunjukkan ikatan-ikatan antar atom dalam sebuah
molekul, yang digunakan untuk menggambarkan ikatan kovalen dan ikatan kovalen
koordinat. Struktur Lewis dikembang oleh ilmuwan Gilbert N. Lewis yang
menyatakan bahwa atom-atom bergabung untuk mencapai konfigurasi elektron yang
lebih stabil.
Untuk
menyusun Struktur Lewis dari suatu atom atau unsur, dapat dilakukan dengan cara
menuliskan sibol titik pada sekeliling atom, dimana setiap titik mewakili satu
elektron yang terdapat pada kulit valensi atom tesebut. Elektron yang
terlibat dalam ikatan ini hanya elektron-elektron yang terdapat pada kulit
terluar dan jumlah total elektron yang terlibat dalam pembentukan ikatan tidak
mengalami perubahan (merupakan jumlah total elektron valensi dari atom-atom
yang berikatan).
Spesies
yang tersusun oleh khusunya unsur-unsur nonlogam seperti H2, O2, N2, H2O, HCl,
dan CH4 ternyata mempunyai sifat yang berlawanan dengan sifat-sifat senyawa
ionik, sifat tersebut misalnya bukan penghantar listrik. Oleh karena itu,
pembentukan ikatan antara atom-atom penyusun molekul menurut model transfer
elektron sebagaimana diterapkan untuk molekul ionik tidak lagi tepat.
Pernyataan yang menantang para ahli kimia pada awal abad ke dua puluh perihal
bagaimana atom-atom itu bergabung membentuk suatu molekul, dijawab oleh Gilbert
N. Lewis pada tahun 1916 yang mengusulkan bahwa elektron valensi suatu atom
dapat divisualisasikan seolah-olah menempati titik-titik sudut suatu kubus di
seputar intinya. Suatu atom yang kekurangan elektron yang diperlukan untuk
menempati kedelapan titik sudut kubus dapat mengadakan "persekutuan"
melalui rusuk kubus dengan atom lain untuk melengkapi pemilikan oktet seperti
pada gambar berikut:
Sebagaimana banyak ide revolusioner umumnya, ide Lewis ini juga ditolak oleh banyak ahli kimia pada waktu itu. Namun demikian konsep pembentukan pasangan-pasangan elektron sekutu kemudian dapat diterima walaupun model diagram kubus tersebut akhirnya hilang tidak mendapat dukungan. Pandangan klasik perihal ikatan kemudian segera berkembang dengan munculnya mekanika kuantum. Linus Pauling pada tahun 1937 mengenalkan model ikatan yang melibatkan tumpang tindih orbital atomik.
Lewis
selanjutnya mengidentifikasi ikatan kimia sebagai pasangan elektron sekutu,
meskipun tidak dapat menjelaskan mengapa pasangan elektron dan bukan jumlah
yang lain harus bertanggungjawab dalam pembentukan ikatan. Pasangan elekron
sekutu yang kemudian dikenal sebagai ikatan kovalen, dilukiskan sebagai ikatan
tunggal A-B untuk sepasang elektron sekutu, ikatan rangkap dua A=B dan ganda
tiga A≡B, masing-masing untuk
dua dan tiga pasangan sekutu. Pembentukan pasangan elektron ini untuk mencapai
konfigurasi elektron terluar delapan, oktet, seperti halnya dijumpai dalam gas
mulia (kecuali He) yang ternyata stabil. Sebagai contoh adalah H2O (air), NH3
(amonia), dan CH4 (metana) sebagai berikut:
Untuk ion,
biasanya muatan dilukiskan untuk satu keseluruhan dan bukan untuk atom secara
individu, khususnya jika atom-atom pengelilingnya sama. Sebagai contoh adalah ion
karbonat sebagai berikut:
IKATAN LOGAM
Ikatan logam adalah suatu kekuatan utama
yang menyatukan atom-atom logam. Ikatan logam merupakan akibat dari adanya
tarik menarik muatan positif dari logam dan muatan negatif dari elektron yang
bergerak bebas. Sifat-sifat logam tidak dapat dimasukkan dalam kriteria ikatan
seperti ikatan kovalen maupun ikatan ion. Senyawa ionik tidak dapat mengantarkan
listrik pada fase padatan, dan senyawa ionik bersifat rapuh (berlawanan dengan
sifat logam).
Atom dari senyawa logam hanya mengandung satu
sampai tiga elektron valensi. Dengan demikian atom tersebut tidak mampu
membentuk ikatan kovalen. Senyawa kovalen merupakan penghantar listrik yang
buruk dan umumnya berupa cairan (dengan sifat berkebalikan dengan pembentukan
logam). Dengan demikian, logam membentuk model ikatan yang berbeda.
Model Lautan
Elektron
Untuk menjelaskan ikatan pada logam,
Lorentz mengusulkan sebuah model yang dikenal dengan model gas elektron atau
model lautan elektron. Model ini didasarkan pada sifat logam berikut:
Energi
ionisasi yang rendah
Logam umumnya mempunyai energi ionisasi yang rendah. Secara tak
langsung, pengertian ini merujuk pada elektron valensi yang tidak terikat
dengan kuat oleh inti. Elektron valensi dapat bergerak dengan bebas diluar
pengaruh inti. Dengan demikian, logam mempunyai elektron yang bebas bergerak.
Banyak
orbital kosong
Telah diteliti bahwa logam mempunyai banyak orbital yang kosong sebagai
akibat elektron valensi logam lebih rendah daripada orbital valensi logam.
Sebagai contoh, logam litium mempunyai orbital 2pyang kosong; natrium
mempunyai orbital 3p dan 5d yang kosong; dan magnesium
mempunyai orbital 3p dan 3d yang juga masih kosong.
Contoh Ikatan
Logam
Elektron yang paling luar pada sebagian besar logam biasanya mempunyai
hubungan yang tidak erat dengan ini karena letaknya yang jauh dari muatan
positif inti. Semua elektron valensi logam-logam bergabung membentuk lautan
elektron yang bergerak bebas di antara inti atom. Elektron yang bergerak bebas
beraksi sebagai ikatan terhadap ion bermuatan positif. Ikatan logam tidak
mempunyai arah. Akibatnya, ikatan tidak rusak ketika logam ditempa.
Skema ikatan logam dapat dilihat pada gambar di bawah ini. Elektron valensi menjadi terdisosiasi dengan inti atomnya dan membentuk lautan elektron.
Skema ikatan logam dapat dilihat pada gambar di bawah ini. Elektron valensi menjadi terdisosiasi dengan inti atomnya dan membentuk lautan elektron.
Contoh ikatan unsur yang mempunyai ikatan logam adalah sebagian besar logam seperti Cu, Al, Au, Ag, dsb. Logam transisi seperti Fe, Ni, dsb membentuk ikatan campuran yang terdiri dari ikatan kovalen (pada elektron 3d) dan ikatan logam.
DLL.

























Tidak ada komentar:
Posting Komentar