Struktur atom merupakan satuan dasar
materi yang terdiri dari inti atom beserta awan elektron bermuatan negatif yang
mengelilinginya.Inti atom mengandung campuran proton yang bermuatan positif dan
neutron yang bermuatan netral (terkecuali pada Hidrogen-1 yang tidak memiliki
neutron). Elektron-elektron pada sebuah atom terikat pada inti atom oleh gaya
elektromagnetik.
Demikian pula sekumpulan atom dapat berikatan satu sama lainnya
membentuk sebuah molekul. Atom yang mengandung jumlah proton dan elektron yang
sama bersifat netral, sedangkan yang mengandung jumlah proton dan elektron yang
berbeda bersifat positif atau negatif dan merupakan ion. Atom dikelompokkan
berdasarkan j pada inti atom
tersebut. Jumlah proton dan neutron, jumlah proton pada atom menentukan unsur
kimia atom tersebut, dan jumlah neutron menentukan isotop unsur tersebut.
Istilah atom berasal dari Bahasa Yunani, yang berarti tidak dapat
dipotong ataupun sesuatu yang tidak dapat dibagi-bagi lagi. Konsep atom sebagai
komponen yang tak dapat dibagi-bagi lagi pertama kali diajukan oleh para filsuf India dan Yunani.
Pada abad ke-17 dan ke-18, para kimiawan meletakkan dasar-dasar pemikiran ini
dengan menunjukkan bahwa zat-zat tertentu tidak dapat dibagi-bagi lebih jauh
lagi menggunakan metode-metode kimia. Selama akhir abad ke-19 dan awal abad
ke-20, para fisikawan berhasil menemukan struktur dan komponen-komponen subatom
di dalam atom, membuktikan bahwa 'atom' tidaklah tak dapat dibagi-bagi lagi. Prinsip-prinsip mekanika kuantum yang digunakan para fisikawan kemudian
berhasil memodelkan atom.
Relatif terhadap pengamatan sehari-hari, atom merupakan objek yang
sangat kecil dengan massa yang sama kecilnya pula. Atom hanya dapat dipantau
menggunakan peralatan khusus seperti mikroskop penerowongan payaran. Lebih dari
99,9% massa atom berpusat pada inti atom, dengan proton dan neutron yang
bermassa hampir sama. Setiap unsur paling tidak memiliki satu isotop dengan
inti yang tidak stabil yang dapat mengalami peluruhan
radioaktif. Hal ini dapat mengakibatkan transmutasi yang mengubah jumlah proton
dan neutron pada inti. Elektron yang terikat pada atom mengandung sejumlah aras
energi, ataupun orbital, yang stabil dan dapat mengalami transisi di antara
aras tersebut dengan menyerap ataupun memancarkan foton yang sesuai dengan
perbedaan energi antara aras. Elektron pada atom menentukan sifat-sifat kimiawi
sebuah unsur dan memengaruhi sifat-sifat magnetis atom tersebut
.
Daftar isi
1 Perkembangan
Model Atom
2 Macam-macam
Model Atom
3 1. Model
Atom John Dalton
4 2. Model
Atom J.J. Thomson
5 3. Model
Atom Rutherford
6 4. Model
Atom Niels Bohr
7. Referensi
Perkembangan Model Atom
Seorang filsuf Yunani yang bernama Democritus berpendapat bahwa jika suatu benda
dibelah terus menerus, maka pada saat tertentu akan didapat akan didapat bagian
yang tidak dapat dibelah lagi. Bagian seperti ini oleh Democritus disebut atom.
Istilah atom berasal dari bahasa yunani “a”
yang artinya tidak, sedangkan “tomos”
yang artinya dibagi. Jadi, atom artinya tidak dapat dibagi lagi. Pengertian ini
kemudian disempurnakan menjadi, atom adalah bagian terkecil dari suatu unsur
yang tidak dapat dibelah lagi namun namun masih memiliki sifat kimia dan sifat
fisika benda asalnya.
Atom dilambangkan dengan ZXA,
dimana A = nomor massa (menunjukkan massa atom, merupakan jumlah proton dan
neutron), Z = nomor atom (menunjukkan jumlah elektron atau proton). Proton
bermuatan positif, neutron tidak bermuatan (netral), dan elektron bermuatan
negatif. Massa proton = massa neutron = 1.800 kali massa elektron. Atom-atom
yang memiliki nomor atom sama dan nomor massa berbeda disebut isotop, atom-atom
yang memiliki nomor massa sama dan nomor atom berbeda dinamakan isobar,
atom-atom yang memiliiki jumlah neutron yang sama dinamakan isoton.
Macam-macam Model Atom
Dalton mengatakan
bahwa atom atom seperti bola pejal atau bola tolak peluru JJ.Thomson mengatakan
bahwa atomm seperti roti kismis E.Rutherford mengemukakan atom seperti tata
surya.
1. Model Atom John
Dalton
Pada tahun 1808, John Dalton yang merupakan seorang guru di
Inggris, melakukan perenungan tentang atom. Hasil perenungan Dalton
menyempurnakan teori atom Democritus. Bayangan Dalton dan Democritus adalah
bahwa atom berbentuk pejal. Dalam renungannya Dalton mengemukakan postulatnya
tentang atom :
1. Setiap
unsur terdiri dari partikel yang sangat kecil yang dinamakan dengan atom
2. Atom
dari unsur yang sama memiliiki sifat yang sama
3. Atom
dari unsur berbeda memiliki sifat yang berbeda pula
4. Atom
dari suatu unsur tidak dapat diubah menjadi atom unsur lain dengan reaksi
kimia, atom tidak dapat dimusnahkan dan atom juga tidak dapat dihancurkan
5. Atom-atom
dapat bergabung membentuk gabungan atom yang disebut molekul
6. Dalam
senyawa, perbandingan massa masing-masing unsur adalah tetap
Teori atom Dalton mulai membangkitkan minat terhadap penelitian
mengenai model atom. Namun, teori atom Dalton memiliki kekurangan, yaitu tidak
dapat menerangkan suatu larutan dapat menghantarkan arus listrik. Bagaimana
mungkin bola pejal dapat menghantarkan arus listrik padahal listrik adalah
elektron yang bergerak. Berarti ada partikel lain yang dapat menghantarkan arus listrik.
2. Model Atom J.J. Thomson
Kelemahan dari Dalton diperbaiki oleh JJ. Thomson, eksperimen yang
dilakukannya tabung sinar kotoda. Hasil eksperimennya menyatakan ada partikel
bermuatan negatif dalam atom yang disebut elektron. Suatu bola pejal yang
permukaannya dikelilingi elektron dan partikel lain yang bermuatan positif
sehingga atom bersifat netral. Gambar atom model Thomson :
Kelemahan model Thomson ini tidak dapat menjelaskan susunan muatan
positif dan negatif dalam bola atom tersebut.
3. Model Atom Rutherford
Model
atom Rutherford
Rutherford melakukan
penelitian tentang hamburan sinar α pada lempeng emas. Hasil pengamatan
tersebut dikembangkan dalam hipotesis model atom Rutherford.
a. Sebagian besar dari atom merupakan permukaan kosong.
b. Atom memiliki inti atom bermuatan positif yang merupakan pusat
massa atom.
c. Elektron bergerak mengelilingi inti dengan kecepatan yang
sangat tinggi.
d. Sebagian besar partikel α lewat tanpa mengalami
pembelokkan/hambatan. Sebagian kecil dibelokkan, dan sedikit sekali yang
dipantulkan.
Kelemahan Model Atom Rutherford
a. Menurut hukum fisika klasik, elektron yang bergerak
mengelilingi inti memancarkan energi dalam bentuk gelombang elektromagnetik.
Akibatnya, lama-kelamaan elektron itu akan kehabisan energi dan akhirnya
menempel pada inti.
b. Model atom rutherford ini belum mampu menjelaskan dimana letak
elektron dan cara rotasinya terhadap inti atom.
c. Elektron memancarkan energi ketika bergerak, sehingga energi
atom menjadi tidak stabil.
d. Tidak dapat menjelaskan spektrum garis pada atom hidrogen (H).
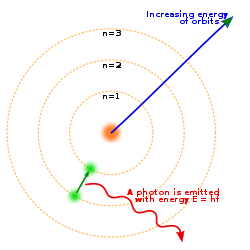
4. Model Atom Niels Bohr
Model
Atom Niels Bohr
Pada tahun 1913, Niels Bohr mengemukakan pendapatnya bahwa elektron bergerak mengelilingi inti atom pada lintasan-lintasan tertentu yang disebut kulit atom. Model atom Bohr merupakan penyempurnaan dari model atom Rutherford.
Kelemahan teori atom Rutherford diperbaiki oleh Neils Bohr dengan postulat bohr :
a. Elektron-elektron yang mengelilingi inti mempunyai lintasan dan
energi tertentu.
b. Dalam orbital tertentu, energi elektron adalah tetap. Elektron
akan menyerap energi jika berpindah ke orbit yang lebih luar dan akan
membebaskan energi jika berpindah ke orbit yang lebih dalam
Kelebihan model atom Bohr
atom terdiri dari beberapa kulit untuk tempat berpindahnya
elektron.
Kelemahan model atom Bohr
a. tidak dapat menjelaskan efek Zeeman dan efek Strack.
b. Tidak dapat menerangkan kejadian-kejadian dalam ikatan kimia
dengan baik, pengaruh medan magnet terhadap atom-atom, dan spektrum atom yang
berelektron lebih banyak.
Referensi
1. ^ a b c d (Indonesia) Siap
Uji menghadapi UN-SPMB, penulis : Priyo Kuncoro, Ihsanudin,
penerbit : Erlangga.
Susunan Atom : Pengertian Nomor
Atom dan Nomor Massa
Susunan
Atom :
Pengertian Nomor Atom dan Nomor Massa - Henry Gwyn-Jeffreys
Moseley (1887 – 1915) pada tahun 1913 menemukan bahwa jumlah muatan positif
dalam inti atom merupakan sifat khas masing-masing unsur. Atom-atom dari unsur
yang sama memiliki jumlah muatan positif yang sama. Moseley kemudian
mengusulkan agar istilah nomor atom diberi lambang Z, untuk menyebutkan jumlah
muatan positif dalam inti atom.
1. NOMOR ATOM (Z)
Nomor atom (Z) adalah nomor yang menunjukkan jumlah proton (muatan positif) atau jumlah elektron dalam atom tersebut. Nomor atom ini merupakan ciri khas suatu unsur. Oleh karena atom bersifat netral maka jumlah proton sama dengan jumlah elektronnya, sehingga nomor atom juga menunjukkan jumlah elektron. Elektron inilah yang nantinya paling menentukan sifat suatu unsur. Nomor atom ditulis agak ke bawah sebelum lambang unsur.
Nomor atom (Z) = jumlah proton = jumlah elektron
Nomor atom (Z) adalah nomor yang menunjukkan jumlah proton (muatan positif) atau jumlah elektron dalam atom tersebut. Nomor atom ini merupakan ciri khas suatu unsur. Oleh karena atom bersifat netral maka jumlah proton sama dengan jumlah elektronnya, sehingga nomor atom juga menunjukkan jumlah elektron. Elektron inilah yang nantinya paling menentukan sifat suatu unsur. Nomor atom ditulis agak ke bawah sebelum lambang unsur.
Nomor atom (Z) = jumlah proton = jumlah elektron
Misalnya, unsur oksigen memiliki
nomor atom 8 (Z = 8), berarti dalam atom oksigen terdapat 8 proton dan 8
elektron.
Selain nomor atom, ada juga yang disebut dengan nomor massa yang
biasanya diberi lambang A. Massa elektron sangat kecil dan dianggap nol
sehingga massa atom ditentukan oleh inti atom yaitu proton dan
neutron. Nomor massa ini digunakan untuk menentukan jumlah nukleon dalam
atom suatu unsur. Nukleon sendiri adalah partikel penyusun inti atom yang
terdiri dari proton dan neutron.
Nomor
massa ditulis agak ke atas sebelum lambang unsur.
Nomor
Massa (A) = Jumlah proton (p) + Jumlah neutron (n)
Dalam
penulisan atom, nomor massa (A) ditulis di sebelah kiri atas, sedangkan nomor
atom (Z) ditulis di sebelah kiri bawah dari lambang unsur.
Keterangan
:
X
= lambang unsur
A
= nomor massa
Z
= nomor atom
Jumlah
Neutron = Nomor massa – Nomor atom
Catatan Kimia :
- Untuk atom netral, jumlah proton sama
dengan jumlah elektron.
- Untuk ion positif, jumlah proton (muatan
positif) lebih banyak daripada elektron (muatan negatif).
- Untuk ion negatif, jumlah elektron
(muatan negatif) lebih banyak daripada proton (muatan positif).
Untuk ion (atom bermuatan positif
atau negatif) maka notasi ion, jumlah proton, neutron, dan elektron adalah:
|
Notasi
|
Ion Positif
|
Ion Negatif
|
|
Jumlah proton (p)
|
p = Z
|
p= Z
|
|
Jumlah neutron (n)
|
n = A – Z
|
n= A – Z
|
|
Jumlah elektron (e)
|
e = p – q
|
e = p + r
|
Contoh :
a. 126C mempunyai
jumlah proton, neutron, dan elektron sebagai berikut.
p
= Z = 6
n
= A – Z = 12 – 6 = 6
Karena
atom netral (tak bermuatan) maka e = p = 6.
b.
Pada ion 199F− mempunyai
jumlah proton, neutron, dan elektron sebagai berikut.
p
= Z = 9
n
= A – Z = 19 – 9 = 10
Karena
muatan F adalah –1 maka r = 1, sehingga:
e
= p + r = 9 + 1 = 10
c. 8838Sr2+ mempunyai
jumlah proton, neutron, dan elektron sebagai berikut.
p
= Z = 38
n
= A – Z = 88 – 38 = 50
Karena
muatan Sr adalah 2+, maka q = 2 sehingga:
e
= p – q = 38 – 2 = 36
Referensi
:
Utami,
B. A. N. Catur Saputro, L. Mahardiani, dan S. Yamtinah, Bakti Mulyani.2009.
Kimia : Untuk SMA/MA Kelas X. Pusat Perbukuan, Departemen Pendidikan Nasional,
Jakarta, p. 250.
Referensi
Lainnya :
[1] Setyawati,
A. A. Kimia : Mengkaji Fenomena Alam Untuk Kelas X SMA/MA. Pusat Perbukuan,
Departemen Pendidikan Nasional, Jakarta, p. 186.
MASSA ATOM DAN MASSA ATOM RELATIF
Massa atom relatif (Ar) merupakan
perbandingan massa atom dengan massa satu atom yang tetap. Standar massa atom yang digunakan
adalah massa atom 12C.
Massa Molekul Relatif (Mr)
Massa molekul relatif (Mr) merupakan penjumlahan dari massa atom relatif. Jadi, massa molekul relatif dapat dirumuskan sebagai berikut.
KONFIGURASI ELEKTRON
Pengertian dan Definisi Konfigurasi
Elektron
Konfigurasi Elektron adalah susunan
elektron-elektron pada sebuah atom. Susunan elektron pada sebuah atom tidak
sembarangan tetapi mengikuti pola atau rumus atau kaidah tertentu yang telah di
tetapkan oleh para ahli kimia yang khusus mempelajari tentang konfigurasi
elektron. Pada Ilmu Kimia, diterapkan tiga aturan dasar atau azas penting yang
menjadi dasar penyusunan konfigurasi elektron suatu atom yaitu prinsip
Aufbau, kaidah Hund dan larangan Pauli. Masing-masing prinsip ini
menjelaskan tentang konfigurasi elektron yang mungkin terjadi pada suatu atom
dengan peraturan-peraturan yang mengikat dan harus terpenuhi.
Konfigurasi elektron pertama kali muncul
saat Niels Bohr, pada tahun 1923 mengajukan teori bahwa periodisitas pada
sifat-sifat unsur kimia dapat dijelaskan oleh struktur elektronik atom yang
bersangkutan. Teori ini didasarkan pada model atom Bohr. Pada saat itu,
Bohr telah mencetuskan teori konfigurasi elektron yang memang sangat
berbeda dengan yang ada sekarang.
Banyak
sekali kelemahan yang menyebabkan konfigurasi elektron Bohr tidak di gunakan
salahsatunya adalah sistem konfigurasi atom Bohr tidak dapat menjelaskan
perubahan spektra atom dalam medan magnet. Sistem konfigurasi elektron Bohr
kemudian di kaji ulang oleh Wolfgang Pauli hingga kemudian
tercetuslah teori larangan pauli.Seperti halnya partikel elementer
lainnya, elektron juga mempunyai sifat-sifat partikel dan gelombang serta
harus patuh pada hukum mekanika kuantum. Elektron dapat berpindah dari satu
atom ke atom yang lain dengan mengeluarkan energi atau emisi dalam bentuk
foton.
Selain
berpindah, satu elektron juga bisa di gunakan oleh atom yang berbeda sehingga
terbentuk suatu ikatan kimia. Konfigurasi elektron mempunyai notasi yang
bersifat universal sehingga bisa di mengerti oleh siapa saja dan dimana saja. Notasi
konfigurasi elektron ini berhubungan dengan untaian label orbital atom
yang diberi label dengan hurup s, p, d, f, g, h,…. Setiap notasi berisi jumlah
atom dan label orbitalnya.
Konfigurasi
elektron menggambarkan penyebaran atau susunan elektron dalam atom.
Pengisian elektron pada kulit-kulit atom memenuhi aturan-aturan tertentu,
yaitu:
a. Jumlah
maksimum elektron pada suatu kulit memenuhi rumus 2n2, dengan n = nomor kulit
Kulit K (n = 1)
maksimum 2 . 12 = 2 elektron
Kulit L (n = 2)
maksimum 2 . 22 = 8 elektron
Kulit M (n = 3)
maksimum 2 . 32 = 18 elektron
Kulit N (n = 4)
maksimum 2 . 42 = 32 elektron, dan seterusnya.
b. Pengisian
elektron pada orbital suatu atom di mulai dari orbital yang paling rendah
s adalah label
orbital paling rendah
p adalah label
orbital ke dua
d adalah label
orbital ke tiga
f adalah label
orbital ke empat, dan seterusnya
c. Jumlah
maksimum elektron pada kulit terluar adalah 8
Contoh Konfigurasi
elektron unsur Stronsium (Sr). Sr mempunyai no Atom 38. Maka konfigurasi
elektronnya adalah sebagai berikut:
Notasi Konfigurasi
elektron Sr (Stronsium) dengan nomor atom 38 adalah sebagai berikut: 1s2 2s2 2p6 3s2 3p63d10 4s24p65s2 .
Artinya:
1. Kulit pertama
(K) berisi 2 elektron pada orbital s
2. Kulit kedua (l)
berisi 8 elektron, 2 pada orbital s dan 6 pada orbital p
3. Kulit ketiga
(M) berisi 18 elekton, 2 pada orbital s, 6 pada orbital p dan 10 pada orbital
d.
4. Kulit keempat
berisi 10 elektron, 2 pada orbital s, 6 pada orbital p,
5. Kulit kelima
berisi 2 elektron yaitu pada orbital s.
Sumber : http://www.kamusq.com/2013/06/konfigurasi-elektron-adalah- pengertian.html#sthash.bXbs2NhH.dpuf
Massa Atom
Relatif dan Massa Molekul Relatif | Berbagi Ilmu Bersama http://irvanfanorama.blogspot.com/2013/02/massa-atom-relatif-dan-massa-molekul.html#ixzz2n9LS6Vti

Tidak ada komentar:
Posting Komentar